
Nilalaman
- yugto
- Paraan 1 Pagbabalanse ng isang equation sa pamamagitan ng pamamaraan ng pagsubok at error
- Pamamaraan 2 Pagsasama-sama ng isang equation ng algebraic na pamamaraan
Sa kimika, ang isang equation ay nagtatatag ng nangyari sa isang reaksyon ng kemikal. Sa kaliwa ng equation, inilalagay namin ang mga reagents na ginamit para sa eksperimento at sa kanan, ang mga produktong nakuha sa panahon ng eksperimento. Ayon sa prinsipyo ng pag-iingat ng masa (Lavoisier) sa panahon ng isang reaksiyong kemikal, walang atom na nawala, walang nilikha, pinagsama nila nang iba. Sa buod, dapat kang magkaroon ng parehong bilang ng mga numero ng bawat elemento sa kanan tulad ng sa kaliwa ng ekwasyon. Iyon ang dahilan kung bakit dapat na palaging balanse ang equation ng balanse.
yugto
Paraan 1 Pagbabalanse ng isang equation sa pamamagitan ng pamamaraan ng pagsubok at error
-
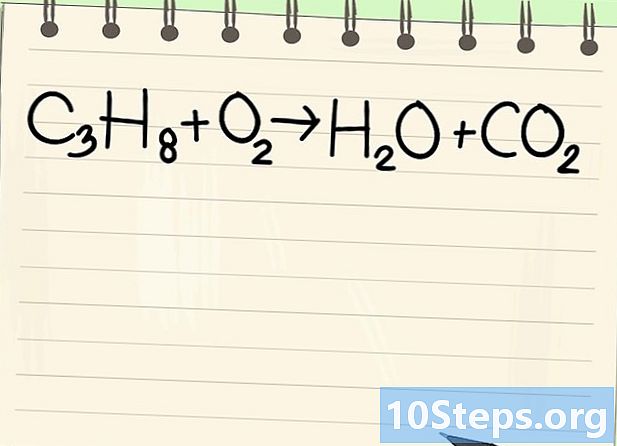
Pansinin ang equation ng balanse. Ituturing namin ang sumusunod na equation:- C3H8 + O2 -> H2O + CO2
- Ito ang equation ng pagkasunog ng propane (C3H8) sa oxygen: ang tubig at carbon dioxide ay nakuha.
-
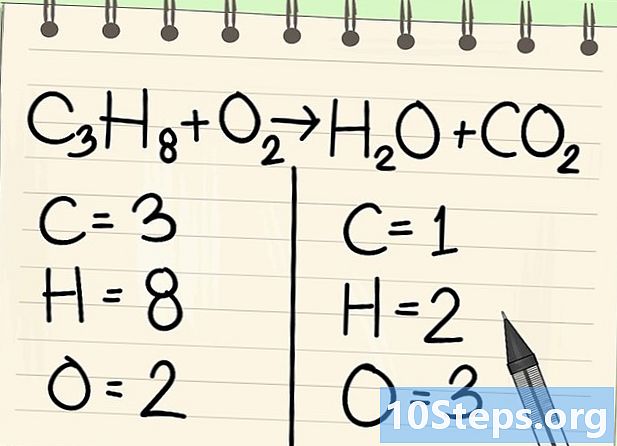
Bilangin ang mga atoms. Ipasok ang bilang ng mga datoms ng bawat elemento sa isang panig ng equation, kung gayon ang iba pa. Para sa mga ito, isaalang-alang ang mga indeks, kung wala, ang index ay 1.- Sa kaliwa, mayroong 3 carbon atoms, 8 hydrogen at 2 oxygen.
- Sa kanan, mayroong 1 atom ng carbon, 2 ng hydrogen at 3 ng oxygen.
-
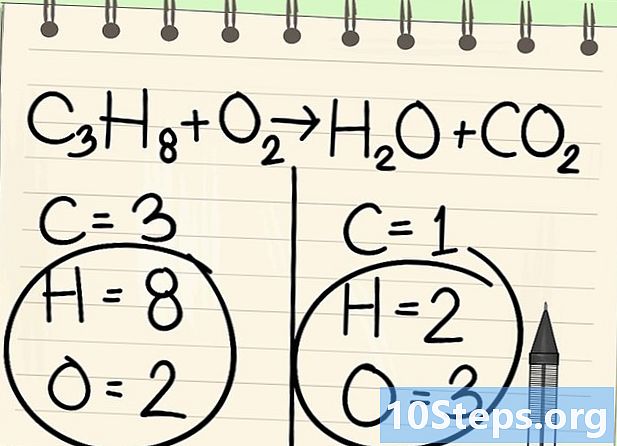
Mag-iwan ng sandali ang hydrogen at ang oxygen. -

Simulan ang pagbabalanse gamit ang tamang elemento. Palagi kaming nagsisimula sa isa sa isang molekula bago at pagkatapos ng reaksyon. Kung mayroong maraming, kunin ang isa na monovalent sa isa sa mga molekula. Dito magsisimula tayo sa mga carbon atom. -

Balansehin ang mga carbon atoms. Idagdag, sa kanan, isang koepisyent sa molekula ng carbon dioxide (CO2) kung saan nag-iisa ang carbon latome. Maglalagay kami ng 3 upang makuha ang 3 kaliwang mga atom.- C3H8 + O2 -> H2O + 3CO2
- Mayroon kaming 3 carbon atoms sa tamang salamat sa koepisyent (3CO2) at 3 carbon atoms sa kaliwa salamat sa index (C3H8).
- Sa isang equation, maaari mong ilagay ang lahat ng mga koepisyentong nais mo, ngunit hindi mo mahipo ang mga pahiwatig.
-
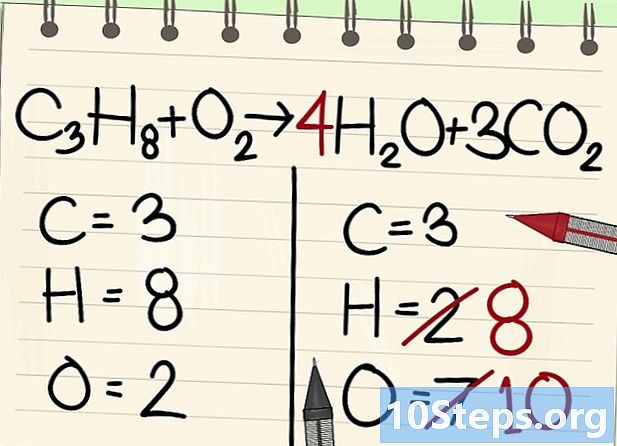
Balansehin ang mga atom ng hydrogen. Tulad ng mayroon kang 8 na natitira sa equation, kailangan mo ng maraming karapatan.- C3H8 + O2 --> 4H2O + 3CO2
- Sa kanan, maglagay ka ng isang koepisyent ng 4, dahil ang hydrogen ay bivalent sa molekula ng tubig: ang index 2 ay nagpapahiwatig na dalawang mga hydrogen atoms ay nauugnay.
- Upang makuha ang bilang ng mga hydrogen atoms sa kanan, pinarami mo ang koepisyent 4 sa index 2, o 8 atoms.
- Tulad ng para sa mga atomo ng oxygen, sa kanan, mayroon na ngayong 6 sa isang panig, na nagmula sa tatlong molekula ng 3CO2 (3 x 2 = 6 atoms) at 4 mula sa 4 na molekula ng 4 H2O (4 x 1 = 4 atoms), ibig sabihin, isang kabuuan ng 10 atoms ng oxygen.
-
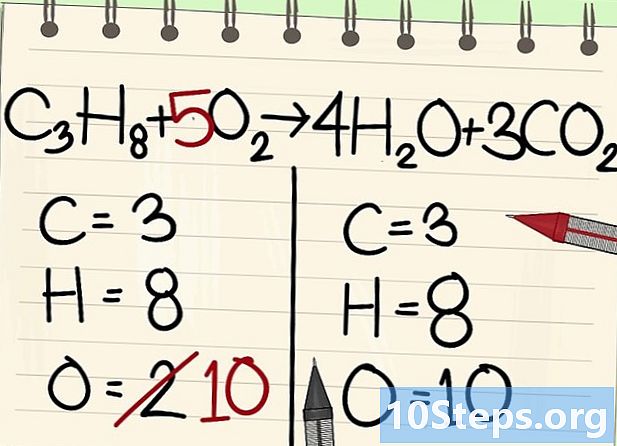
Balansehin ang mga atomo ng oxygen.- Dahil sa balanse ng carbon at hydrogen, ang bilang ng mga atomo ng oxygen ay hindi pareho sa magkabilang panig ng equation. Nakita namin dati na mayroong 10 mga atom ng oxygen sa kanan (4 mula sa mga molekula ng tubig, at 6 mula sa mga molekulang carbon dioxide). Sa kaliwa, mayroon lamang 2 (mula sa O2).
- Upang balansehin ang oxygen, magdagdag ng isang koepisyent ng 5 sa kaliwang molekula ng oxygen: mayroon kang 10 mga atom ng oxygen sa kaliwa at ang isa pa sa kanan.
- C3H8 + 5O2 -> 4H2O + 3CO2
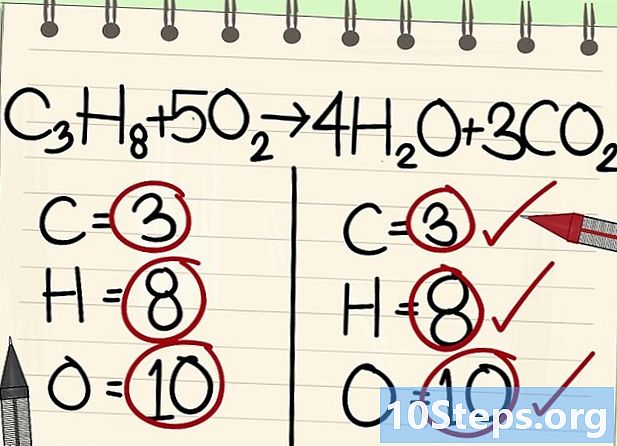
- Lahat ng mga atomo (carbon, hydrogen at oxygen) ay balanse: balanse ang iyong equation.
Pamamaraan 2 Pagsasama-sama ng isang equation ng algebraic na pamamaraan
-

Isulat ang equation upang balansehin. Magtalaga ng bawat molekula ng isang literal na koepisyent. Tatawagan namin sila Wala, b, c at d. -
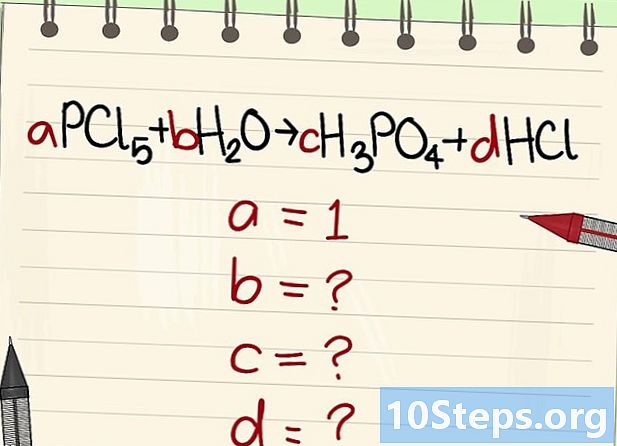
Hanapin ang halaga ng iba pang mga literal na koepisyent. Tatanungin namin iyan Wala = 1. -

Hanapin ang mga ugnayan sa pagitan ng mga koepisyentong ito. Naghahanap ng kaliwa (reagents) at kanan (mga produkto), itinatag ang mga ugnayan sa pagitan ng iba't ibang mga koepisyentong ito.- Kunin ang sumusunod na equation: aPCl5 + bH2O = cH3PO4 + dHCl. Nakasaad na isang = 1, na nangangahulugang c = a, d = 5a at 2b = 3c + d. Tapos na ang mga pagkalkula, c = 1, d = 5 at b = 4.

- Kunin ang sumusunod na equation: aPCl5 + bH2O = cH3PO4 + dHCl. Nakasaad na isang = 1, na nangangahulugang c = a, d = 5a at 2b = 3c + d. Tapos na ang mga pagkalkula, c = 1, d = 5 at b = 4.


