
Nilalaman
Ang bagay ay hindi maaaring nilikha o masira sa isang reaksyong kemikal ayon sa Batas ng Pag-iingat ng Mass, kaya ang mga produktong lumalabas ay dapat na katumbas ng mga reagent na naroroon sa simula. Sa madaling salita, ang parehong halaga ng bawat nakapasok na atom ay dapat ding lumabas. Ang Stoichiometry ay isang pagsusuri ng mga elementong ito, at nagsasangkot ng mga kalkulasyon na isinasaalang-alang ang masa ng mga reagents at produkto sa isang naibigay na reaksyon ng kemikal. Ang Stoichiometry ay nagsasangkot ng kaunting matematika at kaunting kimika, at batay sa isang solong prinsipyo sa itaas: ang bagay na iyon ay hindi kailanman nanalo o nawala sa loob ng isang reaksyon ng kemikal. Ang unang hakbang sa paglutas ng anumang problema sa kemikal ay ang balansehin ang equation.
Mga Hakbang
Paraan 1 ng 4: Pagbalanse ng Chemical Equation

Isulat ang bilang ng mga atoms sa bawat compound sa magkabilang panig ng equation. Sa pamamagitan ng equation ng kemikal, posible na matukoy ang dami ng mga atoms sa bawat elemento ng equation. Dahil hindi posible na lumikha o sirain ang bagay na nakapaloob doon, ang equation ay hindi balanseng kung ang dami (at mga uri) ng mga atoms sa bawat panig ay hindi perpektong katumbas.- Huwag kalimutan na dumami sa pamamagitan ng isang koepisyent o nai-subscribe na halaga, kung naaangkop.
- Halimbawa:
- Sa reagent na bahagi (kaliwa), mayroong dalawang mga hydrogen atoms, isang asupre na asupre, apat na atom ng oxygen at isang iron na bakal.
- Sa gilid ng produkto (kanan), mayroong dalawang mga atom ng hydrogen, tatlong mga asupre ng asupre, mga atomo ng oxygen at dalawang mga atom na bakal.

Maglagay ng isang koepisyent sa harap ng mga elemento maliban sa oxygen at hydrogen upang balansehin ang magkabilang panig. Kilalanin ang pinakamababang karaniwang kadahilanan sa lahat ng mga elemento maliban sa oxygen at hydrogen upang makakuha ng pantay na halaga ng mga atoms sa magkabilang panig.- Halimbawa, ang pinakamababang karaniwang kadahilanan sa pagitan ng dalawa at isa dalawa sa. Ilagay ang isa sa harap ng, sa kaliwang bahagi, upang balansehin ito.
- Ang pinakamababang karaniwang kadahilanan sa pagitan ng tatlo at isa ay tatlo sa. Ilagay ang isa sa harap ng balanse sa magkabilang panig.
- Sa puntong iyon, ang equation ay magiging ganito:

Balansehin ang mga atomo ng oxygen at hydrogen. Ang dalawang sangkap na ito ay balanse sa huling dahil lumilitaw ang mga ito sa maraming mga molekula sa magkabilang panig ng ekwasyon. Sa puntong ito sa balanse, huwag kalimutang muling mabilang ang mga atomo kung naglalagay ka ng mga koepisyenteng molekula.- Sa halimbawa, ang isa ay inilagay sa harap ng at ngayon ay may anim na hydrogen atoms sa kaliwa, na may dalawa lamang sa kanang bahagi ng ekwasyon. Mayroon ding mga atomo ng oxygen sa kaliwa at oxygen atoms sa kanan, na masasabing balanse.
- Posible na balansehin ang mga hydrogens sa pamamagitan ng pagdaragdag ng isa sa harap ng.
- Ang huling balanseng equation ay isusulat tulad ng sumusunod:
Bilangin muli ang bilang ng mga atomo sa bawat panig ng equation upang matiyak na balanse sila. Pagkatapos ng pagtatapos, palaging kapaki-pakinabang na bumalik sa simula at suriin ang balanse ng equation. Magagawa ito sa pamamagitan ng pagdaragdag ng lahat ng mga atomo sa magkabilang panig ng equation upang makita kung tumutugma ang mga halaga.
- Pansinin ang equation sa halimbawa:
- Sa kaliwa ng arrow, mayroong anim na hydrogen atoms, tatlong asupre ng asupre, oxygen atoms at dalawang iron atom.
- Sa kanan ng arrow, mayroong dalawang mga bakal na bakal, tatlong mga asupre ng asupre, mga atomo ng oxygen at walong mga hydrogen atoms.
- Ang kaliwa at kanang panig ng equation ay pinagsama at, samakatuwid, masasabi na balanse sila.
Paraan 2 ng 4: Pag-convert sa pagitan ng gramo at moles
Kalkulahin molar mass sa gramo ng isang tambalan. Ang masa ng molar ay kumakatawan sa dami sa gramo () ng isang nunal ng tambalang pinag-uusapan. Pinapayagan nito ang madaling pag-convert sa pagitan ng gramo at moles ng isang sangkap. Upang makalkula ang masa ng molar, dapat mong makilala kung gaano karaming mga molekula ng isang partikular na elemento ang nasa compound, bilang karagdagan sa atomic mass ng bawat isa sa kanila.
- Tukuyin ang bilang ng mga atoms ng bawat elemento sa isang naibigay na tambalan. Halimbawa, ang glucose ay ipinahayag bilang, sa gayon mayroong anim na carbon atoms, labindalawang hydrogen at anim na oxygen na atom.
- Kilalanin ang atomic mass sa gramo bawat mol () ng bawat atom. Ang masa ng bawat elemento ay karaniwang itinuturo sa ibaba ng kani-kanilang simbolo sa pana-panahong talahanayan, kadalasan sa halaga ng desimal. Ang mga atomic na masa ng mga elemento na naroroon sa glucose ay:
- I-Multiply ang atomic mass ng bawat elemento sa pamamagitan ng bilang ng mga atoms sa compound:
- Ang pagdaragdag ng mga produktong ito ay nagreresulta sa molar mass ng compound.
Ang masa ng isang nunal ng glucose ay katumbas.
I-convert ang gramo ng isang sangkap sa mga moles sa pamamagitan ng masa ng molar. Ginagamit ito bilang isang kadahilanan ng conversion, posible na kalkulahin ang dami ng mga mol na naroroon sa dami ng gramo na nasuri ng isang naibigay na tambalan. Hatiin ang kilalang dami sa gramo () ng masa ng molar (). Ang isang simpleng paraan upang malaman kung ang tamang pagkalkula ay ginawa ay upang suriin kung ang mga yunit ay kanselahin ang bawat isa, naiwan lamang ang mga moles.
- Halimbawa: ilang moles ang nasa gramo ng hydrogen chloride ()?
- Ang atomic mass ng hydrogen ay gramo at ang chlorine ay gramo, kaya ang molar mass ng compound ay nagreresulta sa.
- Ang paghahati ng dami sa gramo ng sangkap sa pamamagitan ng masa ng molar ay nagreresulta sa: mga moles ng.
Alamin ang ratio ng molar sa pagitan ng mga reagents. Upang matukoy ang ani ng isang produkto sa isang tiyak na reaksyon, kinakailangan upang matukoy ang ratio ng molar. Sinasabi sa iyo kung aling mga sangkap ang reaksyon sa iba, na ibinigay ng koepisyent ng mga elemento na naroroon sa balanseng equation.
- Halimbawa, ano ang ratio ng molar sa equation ng kemikal?
- Una, obserbahan kung ang equation ay balanse. Huwag kalimutan ang hakbang na iyon, o ang mga proporsyon ay magiging mali. Sa kasong ito, mayroong pantay na bahagi ng bawat elemento sa magkabilang panig at, samakatuwid, ang ekwasyon ay itinuturing na balanse.
- Ang proporsyon ng may paggalang ay pantay sa. Hindi mahalaga kung aling mga halaga ang nananatili sa numerator at denominador, hangga't mananatili sila sa parehong posisyon sa buong problema.
Dumami ang krus sa pamamagitan ng ratio ng molar upang matukoy ang mga moles ng iba pang reagent. Upang makalkula ang halaga ng mga moles sa isang sangkap na ginawa o kinakailangan sa isang tiyak na reaksyon, gagamitin mo ang ratio ng molar.Ang mga problema ay karaniwang hihilingin sa iyo upang matukoy ang halaga ng mga moles na kinakailangan o ginawa ayon sa isang tiyak na halaga ng gramo ng reagent.
- Halimbawa, isinasaalang-alang ang equation, kung gaano karaming mga moles ng ay gagawa ng gramo ng reaksyon na may sapat na halaga?
- Sa halimbawa, ang sapat na dami na ito ay kumakatawan sa kung ano ang kinakailangan, kaya hindi mahalagang isaalang-alang ang potensyal na halaga upang malutas ang problema.
- Una, i-convert ang halaga sa gramo ng mga moles. Ang atomic mass ng nitrogen ay katumbas ng, upang ang molar mass ng ay katumbas ng. Ang paghihiwalay ng masa sa pamamagitan ng masa ng molar ay magreresulta sa mga moles.
- Alamin ang mga proporsyon na ibinigay ng problema:.
- Palakihin ang pagdaragdag ng ratio ng molar ratio ng tungkol sa, na:
I-convert ang dami sa mga moles pabalik sa masa gamit ang molar mass ng sangkap. Gagamitin mo muli ang molar mass at ngayon, na may isang pagdami upang ma-convert ang mga moles pabalik sa gramo. Tandaan na gumamit ng tamang molar mass ng sangkap.
- Ang molar mass ng katumbas ng. Sa lalong madaling panahon, mula sa.
Paraan 3 ng 4: Pag-convert sa pagitan ng mga litro ng gas at moles
Alamin kung naganap ang reaksyon sa ilalim ng normal na kondisyon ng temperatura at presyon (CNTP). Ito ang hanay ng mga kondisyon kung saan ang isang mainam na nunal ng gas ay sumasakop sa litro () ng lakas ng tunog. Ang karaniwang temperatura, sa kasong ito, ay katumbas ng Kelvin (), habang ang karaniwang presyon ay katumbas ng kapaligiran ().
- Sa pangkalahatan, ang isang reaksyon na nangyayari sa presyon ng at sa temperatura ng ay ipinahiwatig lamang ng acronym CNTP.
Gumamit ng factor ng conversion upang mai-convert ang litro ng gas sa mga moles. Kung ang reaksyon ay nangyayari sa CNTP, maaari mong gamitin ang halaga ng upang makalkula ang halaga ng mga moles para sa isang naibigay na dami ng gas. Hatiin ang halagang ito sa litro () sa pamamagitan ng conversion factor upang makuha ang ninanais na resulta.
- Halimbawa, i-convert ang litro ng gas sa mga moles:
- Halimbawa, i-convert ang litro ng gas sa mga moles:
Gumamit ng Ideal Gas Law upang mai-convert ang mga litro ng gas na wala sa ilalim ng CNTP. Kapag nagtatrabaho sa isang reaksyon sa ilalim ng iba't ibang mga kondisyon, kakailanganin mong gumamit ng Ideal Gas Law () upang matukoy ang dami ng mga moles na naroroon sa isang reaksyon. ay kumakatawan sa presyon sa kapaligiran, kumakatawan sa dami ng gas sa litro, kumakatawan sa dami ng mga moles ng sangkap, ay kumakatawan sa palagiang gas () at kumakatawan sa temperatura sa Kelvin.
- Ang equation ay maaaring maiayos muli upang matukoy ang halaga sa mga moles:.
- Ang mga yunit ng pare-pareho ng gas ay ginagamit upang kanselahin ang iba pang mga variable sa equation.
- Halimbawa, alamin ang dami ng mga moles na naroroon sa litro ng a at. Ang pagpasok ng mga variable sa kanilang mga posisyon, mayroon kami na:
Paraan 4 ng 4: Pag-convert sa pagitan ng mga litro ng likido at mol
Kalkulahin density ng likido. Sa ilang mga kaso, ang mga equation ng kemikal ay nagbibigay ng dami ng isang reagent na likido at humingi ng halaga ng dami na ito sa gramo o moles upang maganap ang reaksyon. Upang mag-convert sa gramo, dapat magamit ang density, isang variable na binubuo ng masa na hinati sa dami.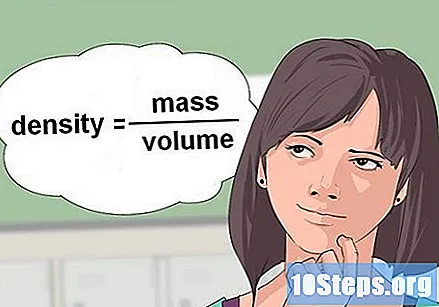
- Kung ang density ay hindi ibinigay sa problema, maaaring kinakailangan upang suriin ang halaga nito sa isang sanggunian ng sanggunian o sa internet.
I-convert ang lakas ng tunog sa mga mililitro (). Upang mai-convert ang dami ng likido sa masa (), dapat mong gamitin ang halaga ng density nito. Ang variable na ito ay ibinibigay sa gramo bawat milliliter (), kaya ang dami ng likido ay dapat na nasa milliliters para sa conversion.
- Kilalanin ang naibigay na dami. Halimbawa, kunwari isang problema na nagpapahiwatig na mayroon kang isang litro ng. Upang mai-convert ang halagang ito, palakihin lamang ito, dahil mayroong mga mililitro sa isang litro ng tubig.
I-Multiply ang dami ng dami ng density. Kapag pinarami mo ang dami () sa pamamagitan ng density ng likido (), ang mga mililitro ay nakansela at ikaw ay naiwan na may mga gramo ng sangkap na pinag-uusapan.
- Halimbawa, ang density ng. Kung ang equation ng kemikal ay mayroon ka, ang halaga ng gramo ay katumbas ng.
Kalkulahin molar mass reagent. Kinakatawan nito ang halaga sa gramo () ng isang nunal ng compound na nasuri, bilang karagdagan sa pagpapahintulot sa iyo na madaling ma-convert sa pagitan ng dalawang yunit na ito. Upang makalkula ang masa ng molar, dapat mong makilala kung gaano karaming mga molekula ng isang naibigay na elemento ang nasa isang tiyak na tambalan, bilang karagdagan sa atomic mass ng bawat isa sa mga elemento na naroroon.
- Tukuyin ang bilang ng mga atoms ng bawat elemento na naroroon sa isang tambalan. Halimbawa, sa glucose (), mayroong anim na carbon atoms, hydrogen atoms at anim na oxygen atoms.
- Kilalanin ang atomic mass sa gramo bawat mol () ng bawat atom. Ang masa ng atomic ng bawat elemento na naroroon sa glucose ay:
- Kilalanin ang atomic mass sa gramo bawat mol () ng bawat atom. Ang mga atomic na masa ng mga elemento na naroroon sa glucose ay:
- Ang pagdaragdag ng mga produktong ito ay nagreresulta sa molar mass ng compound.
Ang masa ng isang nunal ng glucose ay katumbas.
I-convert ang gramo ng isang sangkap sa mga moles gamit ang masa ng molar. Ginagamit ito bilang isang kadahilanan ng conversion, maaari mong kalkulahin ang halaga ng mga moles na naroroon sa tinukoy na halaga ng gramo ng sangkap. Hatiin ang kilalang dami sa gramo () ng masa ng molar (). Ang isang simpleng paraan upang makita kung tama ang pagkalkula ay upang suriin kung kanselahin ang mga yunit, na iniiwan lamang ang mga mol.
- Halimbawa: ilang moles ang nasa hydrogen klorida ()?
- Ang atomic mass ng é at é ay, na nagreresulta sa masa ng compound ng.
- Paghahati ng dami sa gramo ng sangkap sa pamamagitan ng mga masa ng molar ay nagreresulta sa moles ng.


