Nilalaman
Bagaman ang lahat ng mga atom ng parehong elemento ay naglalaman ng parehong bilang ng mga proton, maaaring mag-iba ang bilang ng mga neutron. Alam kung gaano karaming mga neutrons ang isang partikular na atom ay makakatulong sa iyo na matukoy kung ang maliit na butil ay regular sa elementong iyon o isang isotope, na magkakaroon ng higit pa o mas kaunting mga neutron. Ang pagtukoy ng bilang ng mga neutron sa isang atom ay medyo simple at hindi nangangailangan ng eksperimento. Upang makalkula ang bilang ng mga neutron sa isang regular na atom o isotope, sundin ang mga tagubiling ito na may pana-panahong talahanayan.
Mga Hakbang
Paraan 1 ng 2: Paghahanap ng bilang ng mga neutrals sa isang karaniwang atom
Hanapin ang elemento sa pana-panahong talahanayan. Para sa halimbawang ito, tingnan natin ang OS (Os), na nasa ikaanim na hilera, mula sa itaas hanggang sa ibaba.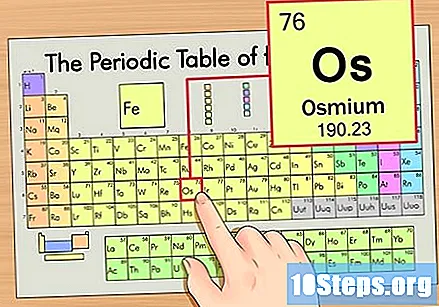
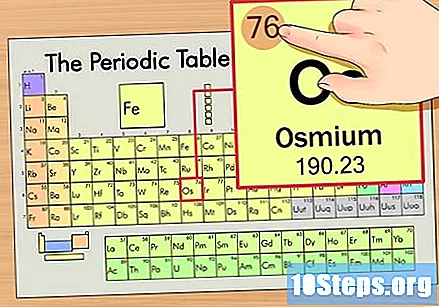
Hanapin ang atomic number ng elemento. Ito ay karaniwang ang pinaka nakikitang numero para sa isang partikular na elemento at karaniwang nasa itaas ng simbolo nito (sa talahanayan na ginagamit namin, sa katunayan, walang iba pang numero na nakalista). Ang bilang ng atom ay ang bilang ng mga proton sa isang solong atom ng elementong iyon. Ang bilang ng Os ay 76, na nangangahulugang ang isang Osmium atom ay may 76 proton.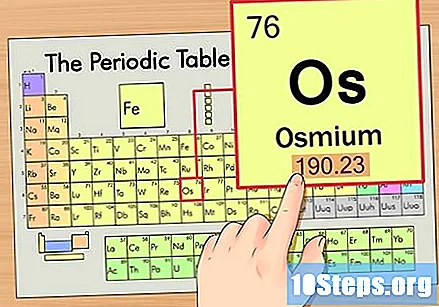
Hanapin ang atom na bigat ng elemento. Ang bilang na ito ay karaniwang matatagpuan sa ibaba ng simbolo ng atom. Tandaan na ang talahanayan sa halimbawang ito ay batay lamang sa numero ng atom at hindi nakalista ang bigat ng atom. Hindi ito palaging magiging ganito. Ang Osmium ay may bigat na atom na 190.23.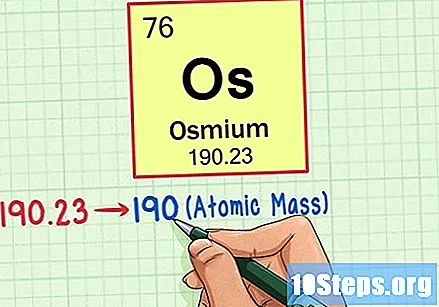
Bilugan ang bigat ng atom sa pinakamalapit na buong bilang upang mahanap ang atomic mass. Sa aming halimbawa, ang 190.23 ay bilugan hanggang 190, na nagreresulta sa isang atomic mass ng 190 para sa Osmium.- Ang masa ng atom ay isang average ng mga isotop ng elemento. Samakatuwid, hindi ito karaniwang isang integer.
Alisin ang numero ng atom mula sa masa ng atomic. Dahil ang karamihan ng masa ng isang atom ay matatagpuan sa mga proton at neutrals nito, ang pagbabawas ng bilang ng mga proton (iyon ay, ang bilang ng atom) mula sa mass ng atom ay magbibigay sa iyo ng bilang kinakalkula ng mga neutron sa atom. Ang bilang pagkatapos ng punto ng desimal sa pangkalahatan ay kumakatawan sa isang napakaliit na masa ng mga electron sa atom. Sa aming halimbawa, ito ay: 190 (atomic mass) - 76 (bilang ng mga proton) = 114 (bilang ng mga neutron).
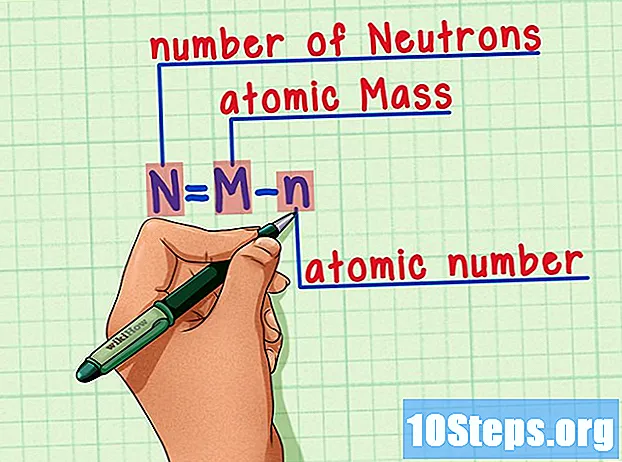
Alalahanin ang pormula. Upang mahanap ang bilang ng mga neutron sa hinaharap, gamitin lamang ang pormula na ito: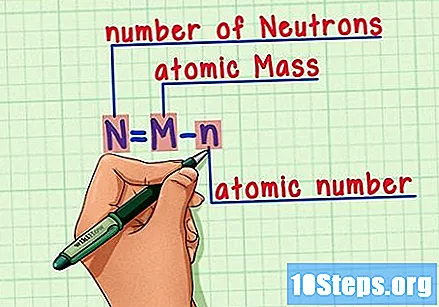
- N = M - n.
- N = bilang ng Neutron.
- M = Matomic na inihaw.
- n = natomic humerus.
- N = M - n.
Paraan 2 ng 2: Paghahanap ng bilang ng mga neutron sa isang isotop
Hanapin ang elemento sa pana-panahong talahanayan. Halimbawa, gagamitin natin ang isotopang carbon-14. Dahil ang di-isotopic form ng carbon-14 ay simpleng Carbon (C), hanapin ang elementong ito sa pana-panahong talahanayan (sa pangalawang hilera).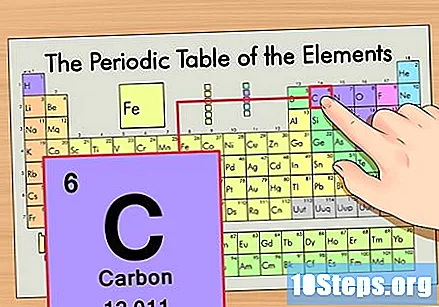
Hanapin ang atomic number ng elemento. Ito ay karaniwang ang pinaka nakikitang numero para sa isang partikular na elemento at karaniwang nasa itaas ng simbolo nito (sa talahanayan na ginagamit namin, sa katunayan, walang iba pang numero na nakalista). Ang bilang ng atom ay ang bilang ng mga proton sa isang solong atom ng elementong iyon. Ang C ay bilang 6, na nangangahulugang ang isang carbon atom ay may 6 na proton.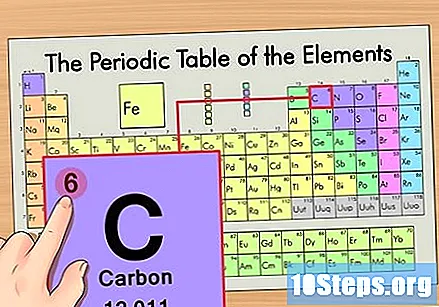
Hanapin ang atomic mass. Ito ay hindi kapani-paniwalang madali sa mga isotopes, dahil pinangalanan sila pagkatapos ng kanilang atomic mass. Ang Carbon-14 ay mayroong isang atomic mass na 14. Kapag nahanap mo ang atomic mass ng isotope, ang proseso para sa paghahanap ng bilang ng mga neutron ay pareho ng ginamit para sa mga ordinaryong atom.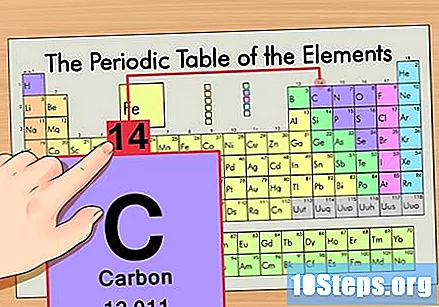
Alisin ang numero ng atom mula sa masa ng atomic. Dahil ang karamihan ng masa ng isang atom ay matatagpuan sa mga proton at neutrals nito, ang pagbabawas ng bilang ng mga proton (iyon ay, ang bilang ng atom) mula sa mass ng atom ay magbibigay sa iyo ng bilang kinakalkula ng mga neutron sa atom. Ang bilang pagkatapos ng punto ng desimal sa pangkalahatan ay kumakatawan sa isang napakaliit na masa ng mga electron sa atom. Sa aming halimbawa, ito ay: 14 (atomic mass) - 6 (bilang ng mga proton) = 8 (bilang ng mga neutron).
Alalahanin ang pormula. Upang mahanap ang bilang ng mga neutron sa hinaharap, gamitin lamang ang pormula na ito: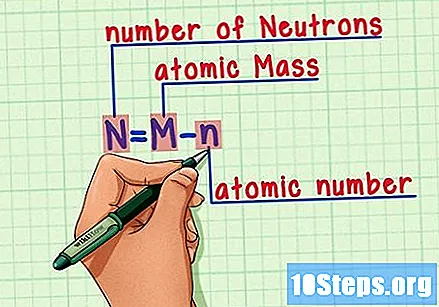
- N = M - n.
- N = bilang ng Neutron.
- M = Matomic na inihaw.
- n = natomic humerus.
- N = M - n.
Mga tip
- Ang Osmium, isang solidong metal sa temperatura ng kuwarto, ay nakukuha ang pangalan nito mula sa salitang Greek para sa 'amoy', 'osme'.
- Ang mga proton at neutron ay bumubuo ng halos buong bigat ng mga elemento, habang ang mga electron at iba pang magkakaibang mga partido ay kumakatawan sa isang napabayaang masa (papalapit sa zero mass). Dahil ang isang proton ay tungkol sa parehong timbang bilang isang neutral at ang numero ng atom ay kumakatawan sa bilang ng mga proton, maaari nating ibawas ang bilang ng mga proton mula sa kabuuang misa.
- Kung hindi ka sigurado kung aling numero ang nasa pana-panahong talahanayan, tandaan lamang na karaniwang ginagawa ito sa paligid ng numero ng atomic (iyon ay, ang bilang ng mga proton), na nagsisimula sa 1 (Hydrogen) at umakyat sa isang yunit bawat kaliwa sa kanan, na nagtatapos sa 118 (Ununóctio). Ito ay dahil ang bilang ng mga proton sa isang atom ay tumutukoy kung ano ang atom na iyon, na ginagawang mas madali upang ayusin ang elemental na katangian (halimbawa, isang atom na may 2 proton ay palaging magiging Helium, tulad ng isa pang atom na may 79 proton ay palaging magiging Ginto).